헤마그르치닌
헤마그르치닌(hemagglutinin, haemagglutinin, HA)이란, 플루 바이러스, 및 그 외 많은 세균, 바이러스의 표면상에 존재하는 항원성당단백질이다.헴아그르치닌과도 표기된다.
바이러스는 이 헤마그르치닌의 기능에 의해서 세포에 감염한다.
헤마그르치닌이라고 하는 단어는, in vitro에 대하고 적혈구(hem)를 굳어지게 해 응집체(agglutinate)를 만드는 것부터 이름이 붙여진[1].
목차
아류형
헤마그르치닌(이하 HA)은 적어도 16 종류가 존재한다.이러한 아류형은 H1로부터 H16의 종류로 나눌 수 있다.플루 바이러스의 아형명(예:H5N1등)의 H는 이 HA의 종류를 나타내고 있다(N는 노이라미니다제의 종류를 나타낸다).마지막에 발견된 H16는, 최근 스웨덴과 노르웨이로부터의 붉은부리갈매기로부터 분리된 예의 봐인[2].또, 과테말라에 있어 박쥐로부터 발견된 헤마그르치닌은 지금까지 알려져 있는 것 머지않아와도 구조가 다르기 위해, 이것을 H17로 하는 것이 제안되고 있는[3].H1, H2, H3의 3 종류는 사람 플루 바이러스에 존재한다.
H5N1(트리인후르엔자:avian flu)는 극히 보기 드물게 사람에도 감염할 가능성이 있다.사람의 환자로 발견된 트리인후르엔자위르스의 H5는 아미노산 배열이 1개 변이하고 있었다.그 때문에, H5N1 바이러스의 리셉터 특성이 변화해 사람에도 감염하게 되었다고 하는 것이 발표된[4][5].이 발견은 통상 사람에는 감염하지 않는 H5N1 바이러스가 어떻게 해 사람의 세포에 감염하는지를 적확하게 설명할 수 있다.
또, 이 H5N1 바이러스의 HA항원의 변이가 높은 병원성의 원인으로도 되어 있는 것을 알 수 있었다.이것은 프로테아제에 의한 활성형에의 전환이 용이하게 되었기 때문이다.
기능과 메커니즘
기능
HA에는 중요한 기능이 2개 있다.
메커니즘
HA는 표적 세포 표면의 시알산에 결합한다.그 때문에, 바이러스가 세포 표면으로부터 멀어지지 않게 된다.바이러스는 그대로 세포막에 감싸지고 바이러스를 넣은 채로 엔드솜의 형태로 세포내에 받아들여진다.
다음에 세포는 엔드솜 내부를 산화시켜, 바이러스를 리소좀에 보내 소화하려고 한다.그러나, 엔드솜의 pH가 6.0까지 저하하면 HA의 구조는 불안정하게 되어, 꺾어 접어진 펩티드 구조가 부분적으로 전개한다.그러자(면) 단백질로 숨겨져 있던 강소수성의 부위가 개방된다.
이 융합 펩티드(fusion peptide)를, 마치 갈고리와 같이 엔드솜막에 삽입해 고정한다.게다가 HA분자의 나머지의 부분은 새로운 구조(보다 낮은 pH에서도 안정인 구조)에 꺾어 다시 접어 융합 펩티드를 끌어 들인다.그러자(면) 바이러스 자신도 엔드솜막에 끌어 들일 수 있어 막과 융합한다.
그 후, 바이러스의 RNA는 세포질에 삽입되어 증식을 개시한다.(PDB molecule of the month: Hemagglutinin (April 2006)도 참조)
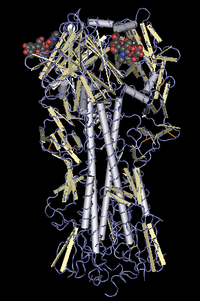
구조
HA는 호모 3량체의 중요한 막당단백질이다.실린더와 같은 형태를 하고 있어, 길이는 대략 135 A이다.
HA를 구성하는 동일한 3개의 모노머는 중심부에α헤릭스를 가지고 있어 이 머리 부분에 시알산결합 부위가 있다.HA의 모노머는 우선 선구체가 합성된다.일전에구체는 후에 그리코실화 되어 분열되어 HA1와 HA2의 2개의 부품이 된다.
각각의 HA모노머는, 막에 구붙은 긴 헤릭스쇠사슬로 구성되어 있다.
참고
- ^ Nelson DL and Cox MM, 2005. Lehninger's Principles of Biochemistry, 4th edition, WH Freeman, New York, NY.
- ^ Fouchier RAM, Munster V, Wallensten A, et al, 2005. Characterization of a novel influenza A virus hemagglutinin subtype (H16) obtained from black-headed gulls. J Virol vol 79, issue 5, pp2814-22
- ^ Suxiang T. et al. 2012. A distinct lineage of influenza A virus from bats. Proc Natl Acad Sci USA 109 : 4269□4274
- ^ Suzuki, Y, 2005. Sialobiology of Influenza: Molecular Mechanism of Host Range Variation of Influenza Viruses in Biological and Pharmaceutical Bulletin, (2005) vol 28, No.3, pp399-408
- ^ Gambaryan A, Tuzikov A, Pazynina G, Bovin N, Balish A, Klimov A, 2006. Evolution of the receptor binding phenotype of influenza A (H5) viruses in Virology vol 344, issue 2, pp432-8
- Yamada S, Suzuki Y, Suzuki T, et al, 2006 Haemagglutinin mutations responsible for the binding of H5N1 influenza A viruses to human-type receptors. Nature vol 444, issue 7117, pp378-82.
- Hatta M, Gao P, Halfmann P, Kawaoka Y, 2001. Molecular Basis for High Virulence of Hong Kong H5N1 Influenza A Viruses in Science vol 293, pp1840-1842.
- Senne DA, Panigrahy B, Kawaoka Y, Pearson JE, Suss J, Lipkind M, Kida H, Webster RG, 1996. Survey of the hemagglutinin (HA) cleavage site sequence of H5 and H7 avian influenza viruses: amino acid sequence at the HA cleavage site as a marker of pathogenicity potential in Avian Disease vol 40, pp425-437.
- Weis WI, Brunger AT, Skehel JJ, et al, 1990. Refinement of the influenza virus hemagglutinin by simulated annealing. J Mol Biol vol 212, pp737-761.
- White JM, Hoffman LR, Arevalo JH, et al, 1997. Attachment and entry of influenza virus into host cells. Pivotal roles of hemagglutinin. In Structural Biology of Viruses. Chiu W, Burnett RM, and Garcea RL, editors. Oxford University Press, NY. pp80-104.
관련 항목
외부 링크
This article is taken from the Japanese Wikipedia 헤마그르치닌
This article is distributed by cc-by-sa or GFDL license in accordance with the provisions of Wikipedia.
In addition, Tranpedia is simply not responsible for any show is only by translating the writings of foreign licenses that are compatible with CC-BY-SA license information.
0 개의 댓글:
댓글 쓰기